Infertilidad bacteriana
ABORTOPara más información consulte el capítulo 5.
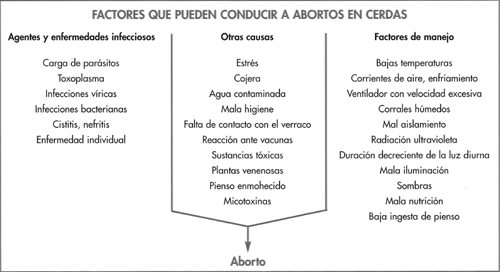
Los factores asociados con el aborto son complejos, diversos y con frecuencia están interrelacionados. La figura 6-7 muestra los factores que contribuyen a los abortos de causa infecciosa o relacionados con factores del manejo de la explotación. Los agentes in fecciosos pueden producir abortos de tres maneras:
- Invasión de la placenta, que causa inflamación (placentitis) y en algunos casos necrosis (muerte de tejidos) que elimina el aporte de nutrientes y oxígeno al feto.
- Invasión y mortalidad del feto.
- Multiplicación en otras partes del cuerpo causando fiebre y a veces toxemia (toxinas en la sangre).
Para prevenir la micotoxicosis:
- Controlar los silos de pienso. ¿Son impermeables?
- ¿Cuándo se realizó la última inspección interna?
- ¿Contienen pienso cubierto por moho?
- ¿Están los depósitos cargados con pienso caliente?
- ¿Se tratan los depósitos regularmente para prevenir el crecimiento de moho?
- ¿Se mantienen los sacos de pienso en un lugar frío y seco o húmedo y caliente?
- Si la mezcla de pienso es casera y se ofrece alimentación líquida ¿están los tanques y las tuberías libres de moho?
- ¿Alguna vez se ofreció pienso ligeramente mohoso a las cerdas?
- ¿Se revisan los techos de los tanques de mezcla para verificar si el alimento salpicado sobre ellos tiene moho?
- ¿Se controlan las tuberías?
- ¿Se controlan las materias primas?
- ¿Quedan los componentes líquidos de la mezcla expuestos al clima cálido en los tanques de almacenamiento?

BRUCELOSIS
Para más información consulte el capítulo 12.
Esta enfermedad se debe a la bacteria Bruce/la suis, que es una de las seis especies de Bruce/la. Bruce/ la suis no existe en el Reino Unido, Irlanda ni en


Comprenden infertilidad y abortos en cualquier momento de la gestación . La infección en la cerda a partir del verraco durante la cubrición causa abortos tempranos, por lo general antes del día 35 y repeticiones acíclicas de celo. Las cerdas que abortan después del día 30 pueden tener secreción ~aginal sa_nguinolenta con un número elevado de microorganismos. En los lechones lactantes y destetados, B. suis puede infectar los huesos y tejidos blandos causando parálisis de los miembros posteriores. El estado portador persiste durante· períodos prolongados.
Diagnóstico
Se establece mediante el aislamiento del microorganismo. La serología permite detectar cerdas portadoras aunque se han descrito reacciones cruzadas extensas con Yersinia enterocolitica. Para ello se emplea la prueba de aglutinación del suero (PAS) y los resultados
superiores a 31 unidades internacionales (UI) se consideran positivos. La prueba de fijación del complemento (PFC) se emplea junto con la PAS con fines de evaluación de animales de exportación dentro de la UE.
Normas empleadas por la UE para el comercio dentro de la comunidad
Prueba de aglutinación del suero (PAS) - Positiva con más de 31 UI.
Prueba de fijación del complemento (PFC) - Positiva con más de 25 UI.
Tratamiento
No se dispone de un tratamiento eficaz. Los antibióticos obtienen poca respuesta.
Control del manejo y prevención
- Se fundamenta en la identificación de granjas libres de infección por B. suis y en su mantenimiento comprando los cerdos sólo en explotaciones libres de enfermedad. Algunos países están implementando programas de erradicación mediante identificación y eliminación de granjas infectadas .
- Cuando un país se declara libre de brucelosis, la evaluación serológica del stock de cría de reposición es una medida muy eficaz para prevenir la diseminación de la enfermedad.
ENDOMETRITIS Y SINDROME DE SECRECION VULVAR
Desde 1985 se ha observado una reducción gra-

Signos clínicos
Las secreciones vulvares son comunes en los 3-4
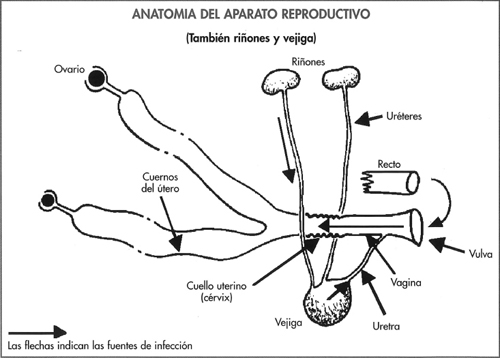

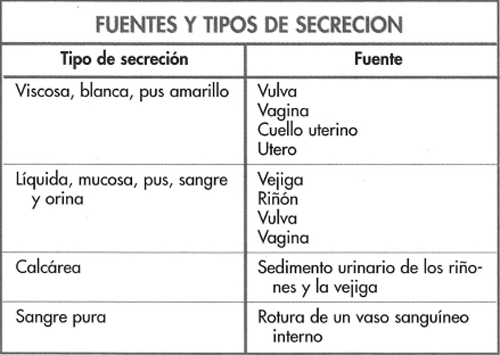
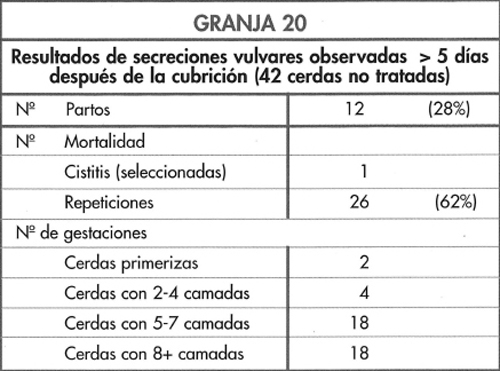
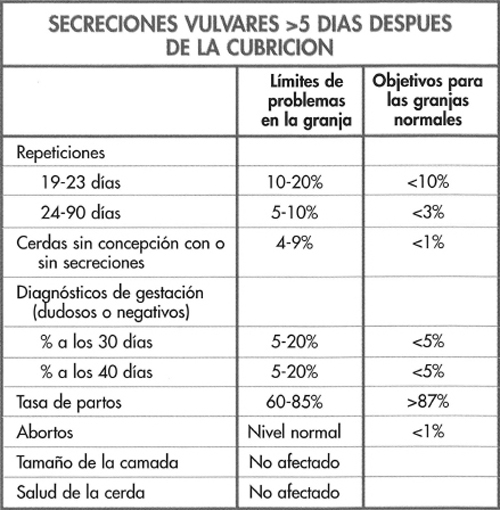
Los cambios observados se presentan en la figura 6-14 y destacan los incrementos de las repeticiones y de cerdas no gestantes y con secreción, aunque una proporción de cerdas con secreción se mantuvo gestante. En estos casos la infección se origina en la vagina o en la vejiga. Si bien se ha observado un incremento de las pruebas de gestación dudosas o negativas a los 30-40 días, los niveles de abortos, camadas pequeñas y de salud de las cerdas se mantuvieron normales.
Diagnóstico
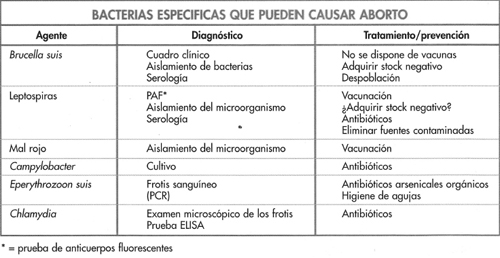
Las bacterias que causan infecciones del aparato reproductivo se enumeran en la figura 6-15. Los principales microorganismos asociados con endometritis

- Estación.
- Raza de la cerda.
- Fuente de reposición.
- Fuente de verracos.
- Inseminación artificial.
- Cistisis/pielonefritis.
- Secreciones durante la lactación.
- Asistencia en el parto.
- Secreción antes de los 5 días postcubrición.
.jpg)
Endometritis = inflamación del epitelio uterino
- Granjas con numerosas cerdas viejas.
- Período de lactación breve (14-21 días).
- Cubriciones múltiples. Verracos de cubrición cruzada.
- Manipulación del prepucio durante la cubrición y expresión del saco prepucial.
- Cubrición no supervisada.
- Cubriciones al final del estro.
- Corrales de verracós húmedos y sucios. Mal drenaje. Utilización continua.
- Corrales de cubrición húmedos y sucios con utilización continua y sin limpieza.
- jaulas de gestación pequeñas donde la cerda adopta una postura de perro sentado que promueve la contaminación vulvar.
- Alojamiento de cerdas primerizas vírgenes en jaulas.
- Contaminación vulvar importante, por ejemplo, en cerdas primerizas vírgenes alojadas en corrales con rejillas que promueven el rebosamiento de los purines.
- Mortalidad temprana de embriones.
- Cubrición de cerdas con secreción. sss
- Utilizar verracos viejos con cerdas jóvenes.
- Utilizar verracos jóvenes con cerdas viejas.
Diagnóstico
Se realiza en tres partes:
- Estudio de los registros, como ya se describió.
- Observaciones regulares de la vulva, en especial en los 14-21 días después de la cubrición para identificar a las hembras afectadas.
- Exámenes bacteriológicos de las secreciones vaginales y prepuciales. Evaluar todos los verracos y 1 O cerdas que tuvieron repetición de celo. Introducir un hisopo en el prepucio mientras el verraco está comiendo, confinado en un establo o inmediatamente después de desmontarse tras la monta. Asimismo, en las cerdas con problemas los labios vulvares se deben limpiar con un tejido fino, separar e insertar un hisopo hasta su longitud completa. A continuación, se pueden determinar los microorganismos predominantes en la granja y realizar el antibiograma. Si bien es correcto examinar los hisopos de secreciones individuales, los resultados no siempre son útiles. Sin embargo, permiten identificar microorganismos como Klebsiella, que es un patógeno primario. La figura 6-18 muestra un resultado de laboratorio típico y algunos de los antibióticos que se podrían emplear. Estos resultados se obtuvieron en una granja donde el 24% de las cerdas cubiertas repitieron y algunas de las cerdas infértiles presentaron secreción viscosa 12-20 días después de la cubrición. El cuadro bacteriológico muestra una tasa elevada de aislamiento de Klebsiella del prepucio de los verracos (90%). El nivel en una granja normal es inferior al 1 0%. Otros exámenes mostraron que el 30% de las cerdas con problemas eran portadoras del mismo microorganismo. Klebsiella es un patógeno oportunista reconocido y la amoxicilina fue el tratamiento de elección, de acuerdo con el antibiograma. Se depositaron 3 mi de solución inyectable en la región anterior de la vagina de todas las cerdas 6-24 horas después de la última cubrición. Esto se realizó durante un período de 4 meses y también se colocaron 7 mi en el prepucio de cada verraco 1 vez cada 3 semanas, en cinco ocasiones. La tasa de concepción se elevó al 88%.
- Es aconsejable considerar los aspectos terapéuticos con su veterinario, pero existen tres métodos de tratamiento, antibióticos aplicados en el prepucio, en inyección intramuscular o por vía oral (fig. 6-19). La administración oral se facilita realizando una premezcla de pienso con antibiótico y colocando una cantidad pequeña de esta mezcla en el pienso todos los días durante un período de 1 O días. También se pueden emplear preparaciones de acción prolongada en inyección intramuscular, aunque es preferible evitarlas porque pueden asustar al animal. Ante la sospecha de leptospirosis, se debe administrar una
.jpg)
Tratamiento de la cerda
- El método más eficaz es colocar un antibiótico en la región anterior de la vagina hasta alcanzar el cuello uterino (pero sin penetrarlo). En general, se emplea una dosis de 3 mi de la mayor parte de los antibióticos inyectables; la selección depende del resultado del examen bacteriológico y el antibiograma. Se puede emplear un catéter desechable de diámetro pequeño para IA o un catéter de IA para el ganado vacuno. Acortarlo aproximadamente a 150 mm. Acoplar una jeringa con adaptador. Llenar por completo el catéter y la jeringa con el antibiótico. A continuación, insertar el catéter hasta el cuello uterino pero sin penetrarlo y depositar el antibiótico. Esto se puede realizar 6-24 horas después de la última cubrición. Sin embargo, es importante supervisar los resultados durante las primeras 3 semanas para detectar efectos adversos relacionados con secreciones y con las tasas de repeticiones. Otro método de medicación es medicar el pienso de la cerda desde el destete hasta el ~ía 21 postcubrición. En granjas con problemas importantes puede ser necesario medicar a todas las hembras reproductoras incorporando el antibiótico apropiado al pienso durante 1 O días. Es aconsejable considerar con su veterinario estos métodos tal como se los describe en las figuras 6-19 y 6-20.
.jpg)
- Controlar la vulva para identificar secreciones .
- No realizar la cubrición al final del celo .
- No repetir la cubrición en cerdas sucias .
- La cerda sólo se debe cubrir cuando es totalmente receptiva al verraco. Si existen dudas, esperar .
- No intentar realizar la cubrición demasiado temprano .
- Considerar la cubrición en un solo día, con el verraco por la mañana e IA al anochecer.
- Considerar sólo una cubrición .
- Utilizar sólo un verraco con una cerda .
- Evitar la humedad y la suciedad en los corrales de verracos y de cubrición. Limpiar y desinfectar los corrales regularmente.
.jpg)
- Evitar los períodos de lactación inferiores a 21 días.
- Incrementar el número de cerdas primerizas disponibles para la cubrición.
- Los verracos jóvenes sólo deben montar a hembras jóvenes.
- Evitar la contaminación fecal importante de la vulva desde el destete hasta el día 14 después de la cubrición.
EPERITROZOONOSIS (EPE)
Para más información consulte el capítulo 8.
Esta enfermedad se debe a la bacteria Eperythrozoon suis, que se fija a la superficie de los eritrocitos y en algunos casos los destruye. El animal se puede volver anémico y los productos de la destrucción celular pueden causar ictericia. La enfermedad clínica es más común en cerdos en crecimiento, aunque puede causar problemas reproductivos en la granja. Una cerda portadora de Epe puede mantenerse sana, pero la bacteria puede atravesar la placenta e infectar a los fetos causando neohatos débiles. La enfermedad se puede transmitir mediante inoculación directa, a través de piojos del cerdo, moscas domésticas, ácaros de la sarna y tal vez más importante, a través de las agujas empleadas para aplicar inyecciones en los cerdos. La Epe también puede ingresar por la boca y alcanzar el estómago y el intestino y ser transferida al organismo por esta vía. Por esta razón no se aconseja la práctica de retroalimentación con placenta. La Epe está presente en la mayor parte de las granjas, si no en todas, pero no se han establecido los mecanismos que la vuelven patógena en algunas poblaciones y en otras no. La incidencia de la enfermedad es baja.

Enfermedad aguda
Las cerdas afectadas presentan anorexia y fiebre de 40-42ºC (105-107ºF) en presencia de bacteriemia elevada. Este cuadro clínico se observa después del parto y la anemia es un síntoma común. Las cerdas en período de destete sufren infecciones agudas similares junto con el anestro.
Enfermedad aguda
Las cerdas se vuelven débiles y pálidas y presen tan ictericia, tasas bajas de concepción, repetición de celos y anestro. Los signos de infertilidad atribuidos a Epe son:
- Repeticiones de celo retrasadas.
- Anemia.
- Ictericia.
- Sangrado intratisular.
- Aborto.
- Bajas tasas de concepción .
Es una situación frecuente y la sangre constituye una fuente constante de transmisión en la granja, especialmente cuando las hembras son vacunadas con la misma aguja.
Diagnóstico
Se establece mediante el examen microscópico de un frotis de sangre con coloración especial (Wright) para identificar el microorganismo. La presencia de Epe en un frotis no siempre implica enfermedad y existen controversias acerca del papel que cumple esta bacteria y su capacidad para causar enfermedad.
Tratamiento
- Se ha empleado ácido arsanílico, 90 g/tonelada para administrar una dosis de alrededor de 250 mg/día a cada hembra.
- En las granjas infectadas con sarna se debe instituir un programa de control.
- Se ha declarado que la oxitetraciclina en dosis de 400 g/tonelada durante 4 semanas produce cierto efecto pero la respuesta al tratamiento suele ser sólo moderada.
No existen métodos conocidos para prevenir esta enfermedad, aparte del cambio frecuente de agujas para reducir su transmisión en la granja. La infección con virus PRRS podría desencadenarla.
- Tomar precauciones durante la vacunación de un número elevado de cerdas. Cambiar las agujas cada 2 a 3 cerdas y cerdas primerizas.
- Limpiar la aguja con una tela de algodón y alcohol quirúrgico después de inyectar a cada animal.
- Reducir los episodios de lucha .
- Tomar precauciones para reducir al mínimo los procesos de descomposición .
- No realizar la retroalimentación utilizandd placenta o líquidos del parto .
- Mantener un nivel mínimo de estrés y de inmunosupresión.
- Controlar la sarna y los piojos, si están presentes .
- Controlar los insectos mordedores.
MAL ROJO
El mal rojo porcino se debe a la bacteria Erysipe/ othrix rhusiopathiae, presente en la mayor parte o todas las granjas porcinas. Hasta el 50% de los animales porta esta bacteria en las tonsilas. Como se excreta a través de la saliva, las heces o la orina, siempre está presente en el cerdo o en su medio ambiente. También se encuentra en muchas otras especies, como aves y ovejas y puede sobrevivir fuera del cerdo durante algunas semanas y durante períodos más prolongados en suelos livianos. Por estos motivos es imposible erradicarla de la granja. Las heces infectadas parecen ser la fuente principal de infección, especialmente en corrales de crecimiento y de cebo. La enfermedad es poco frecuente en cerdos menores de 8-12 semanas de vida debido a la protección que confieren los anticuerpos maternos a través del calostro. Los animales más susceptibles son los cerdos en crecimiento, las cerdas primerizas no vacunadas y las cerdas de hasta cuatro partos.
Signos clínicos
El microorganismo se multiplica en el cuerpo y pasa a la sangre produciendo septicemia. Por lo tanto, la rapidez de la multiplicación y el nivel de inmunidad del cerdo determinan la aparición de signos clínicos. Estos se dividen en tres tipos.
Enfermedad sobreaguda o aguda
Tiene inicio súbito y con frecuencia el único signo es la muerte. Este cuadro es muy raro en lechones lactantes. En verracos y cerdas produce temperaturas muy elevadas, de 40ºC (108ºF) y enfermedad evidente, aunque algunos animales parecen normales. Durante esta fase aguda se producen abortos o bien muerte y momificación de 1 o 2 fetos. Los microorganismos bloquean los vasos sanguíneos delgados de la piel del lomo y de los flancos causando trombosis. La restricción del aporte de sangre produce áreas sobreelevadas pequeñas conocidas como lesiones en diamante. Estas lesiones se vuelven rojas y por último negras debido a la necrosis tisular. Con frecuencia, estos nódulos se palpan en los primeros estadios de la enfermedad antes de ser visibles. No es infrecuente la muerte súbita debido a septicemia o a insuficiencia cardíaca.

La cerda parece anoréxica y puede presentar lesiones cutáneas características. La temperatura es de 39- 40ºC (102-104ºF) pero en algunos casos la enfermedad es muy leve y no se detecta. En ocasiones se produce muerte fetal intrauterina y momificación.
Enfermedad crónica
Se observa después de las formas aguda o subaguda (aunque no en todos los casos). El microorganismo invade las articulaciones produciendo cojera o las válvulas cardíacas, donde induce proliferación del tejido conectivo. La enfermedad esporádica es común en cerdas pero si afecta a una cerda de un grupo, la eliminación de bacterias en la orina y las heces determina una exposición elevada y es conveniente inyectar penicilina a todos los animales en contacto. Los efectos reproductivos importantes del mal rojo comprenden:
- Animales enfermos con fiebre elevada.
- Abortos durante la enfermedad aguda o subaguda con cerdas enfermas y mortalidad de lechones.
- Mortalidad fetal con momificación intrauterina .
- Abortos con fetos en descomposición.
- Reabsorción de embriones y retorno al celo retrasado.
- Repetición normal si la infección comenzó inmediatamente después de la cubrición.
- Camadas de tamaño variable.
Diagnóstico
Se fundamenta en el cuadro clínico y el aislamiento del microorganismo, que crece con facilidad en el laboratorio. La serología señala exposición al microorganismo, pero sólo se indica para confirmar el diagnóstico cuando se detectan títulos crecientes en un intervalo de 14 días.
Interpretación de los títulos (prueba de inhibición de la hemaglutinación)
1 :4 -1 :64, vacunación.
1 :32-1 :320, sugiere anticuerpos maternos o exposición al microorganismo.
> 1 :640, sugiere infección previa.
Una elevación de los títulos desde 1 :320 hasta 1 :1280 podría indicar infección activa. El mal rojo se puede convertir en un problema en granjas con PRRS endémico.
Tratamiento
- Este microorganismo es muy sensible a la penicilina. Los animales con enfermedad aguda deben recibir penicilina de acción rápida cada 12 horas durante 3 días. También se puede administrar una penicilina de acción prolongada en una sola dosis para cubrir 48 horas de tratamiento y luego repetirla.
- Una inyección intramuscular de 1 ml/ l O kg de peso corporal (300.000 Ul/ml).
- Medicar el pienso con 200 g/tonelada de fenoximetil penicilina durante 1 0-14 días. Este es un método de prevención muy eficaz y se puede emplear en brotes importantes de la enfermedad.
- Un verraco enfermo, con fiebre elevada y lesiones cutáneas debe recibir tratamiento de inmediato y no se debe emplear para la cubrición durante un período mínimo de 4 semanas. De otra manera, proceder al servicio con verracos sin antecedentes de enfermedad o utilizar IA.
- Vacunar 2 veces a todas las cerdas primerizas y verracos jóvenes con un intervalo de 2 a 4 semanas (de acuerdo con las instrucciones del fabricante) a partir de las 14 semanas de vida.
- Las granjas con riesgo elevado pueden requerir una tercera dosis de vacuna en cerdas primerizas y verracos, aplicada 2 meses después de la segunda dosis, por lo general cuando los animales reproductores llegan a la granja.
- Revacunar a las cerdas 2 semanas antes del parto o en el destete, de acuerdo con la incidencia y los antecedentes de la enfermedad en la granja.
- Verificar si los verracos fueron revacunados cada 6 meses.
- Los brotes de la enfermedad pese a la vacunación pueden indicar un nivel elevado de riesgo ambiental. Valorar la higiene de los corrales de cría e implementar un método de manejo de todo dentro/todo fuera.
- Los sistemas de alimentación húmedos, en especial cuando se emplean derivados lácteos, pueden ser fuentes importantes de multiplicación del microorganismo.
- Las vacunas con bacterias muertas son bastante seguras y no producen efectos adversos en las cerdas.

LEPTOSPIROSIS
Las leptospiras son bacterias alargadas helicoidales, presentes en la mayor parte de las especies de mamíferos. Se conocen más de 160 serotipos y algunas especies producen infecciones cruzadas. Cada serotipo tiene uno o más hospedadores (por lo general dos o tres) que multiplican el tipo y lo mantienen. Un serotipo puede persistir como infección durante toda la vida en su hospedador reservorio. El cerdo es un hospedador reservorio de Leptospira pomona, L. tarassovi, L. bratislava y L. muenchen, las dos últimas tienen una relación estrecha entre sí. Aunque los cerdos no son hospedadores de L. icterohaemorrhagiae se pueden infectar con orina de rata y enfermar. Los cerdos también se pueden infectar con otros serotipos presentes en la orina de otros animales, como L. canicola proveniente de perros y L. hardjo proveniente del ganado vacuno, pero estos serotipos producen infecciones subclínicas que no causan enfermedad. Por lo tanto, el cerdo es un hospedador accidental, es decir que no perpetúa la infección y sólo es responsable de una diseminación mínima. Leptospira pomona causa problemas reproductivos importantes en cerdas reproductoras y tiene una diseminación lenta en la granja. Este microorganismo persiste en la granja cuando no se implementan medidas de erradicación. No se encuentra en el Reino Unido ni en Irlanda y parece haber desaparecido de Europa occidental pero tiene una amplia distribución en corrales porcinos del resto del mundo. El zorrino o mofeta es un hospedador reservorio alternativo en América. L. tarassovi causa un síndrome similar (conjunto de signos y lesiones) al producido por L. pomona aunque tiende a ser más leve y con diseminación más lenta. Se encuentra en Europa oriental y en las Antípodas. Se considera que algunos animales salvajes actúan como hospedadores reservorios. El cerdo también es un hospedador reservorio de ciertos subtipos de L. bratislava y L. muenchen, que tienen una amplia distribución en cerdos de todo el mundo. Estos subtipos causan un síndrome diferente al de L. pomona y L. tarassovi y afectan especialmente a cerdas primerizas gestantes y a hembras de segundo parto que no han tenido contacto previo con estos microorganismos. Una vez que estas bacterias han ingresado a la
.jpg)
- Introducción de cerdas primerizas y verracos infectados.
- Otros animales.
- Exposición de la granja a fuentes indirectas de contaminación, como agua contaminada.
- Infección por vía oral, a través de las membranas mucosas.
- La mayor parte de las leptospiras son habitantes del riñón y se detectan en la orina.
- Introducción y diseminación en la granjas a partir de diferentes animales de vida silvestre.
- Introducción y diseminación debido a la llegada de verracos y cerdas primerizas portadores.
- La transmisión entre cerdos a través de la orina es común.
- La infección venérea es frecuente, en especial con L. bratislava/muenchen.
- Contaminación del agua, superficies del suelo, albercas y corrientes de agua.
- Revolcaderos utilizados en la producción al aire libre, si tienen albercas de agua corriente.
Signos clínicos
Los brotes agudos se asocian con inapetencia y depresión, pero la enfermedad crónica leve es más común y produce abortos, nacidos muertos e incremento de lechones no viables. Una tasa de abortos superior al 1 % en una granja requiere iniciar la búsqueda de leptospirosis. Otro factor asociado en especial con infección por L. bratislava es la reducción de las tasas de parto y del número de nacidos vivos por cerda. Signos asociados con enfermedad aguda por L. bratislava:
- Las cubriciones repetidas son comunes en especial en la primera gestación y en cierto grado en la segunda de cerdas primerizas.
- Esto suele continuar con la pérdida del embrión y a veces con secreciones vaginales copiosas.
- Abortos tardíos.
- Incremento de lechones prematuros.
- Incremento de nacidos muertos.
- Camadas mixtas de lechones débiles y nacidos muertos.
- Aumento de fetos momificados.
- Aumento de animales con repeticio;·1es.
- Es común hallar un ciclo de enfermedad de 2 años.
- La ineficacia reproductiva afecta más a hembras con una segunda camada que a cerdas primerizas después de la cubrición con verracos portadores de edad avanzada.
- La enfermedad es menos común en animales viejos.
- La enfermedad puede ser difícil de reconocer en granjas con estado portador prolongado.
Se fundamenta en los nivel¿:; de anticuerpos en una muestra transversal de hembras reproductoras y en el aislamiento del microorganismo de tejidos enfermos. La prueba de microaglutinación se realiza en el suero y los animales con afección reciente tienen títulos de hasta 1:1000. Cuando comienzan los signos clínicos se debe obtener una muestra de sangre y otra al cabo de 2 semanas. Si la segunda muestra exhibe un incremento no inferior al doble en los títulos de anticuerpos, se debe sospechar infección por leptospiras. El crecimiento de estos microorganismos es difícil y requiere un período prolongado. El crecimiento de L. bratislava/muenchen es aun más difícil y pocos laboratorios pueden cultivarlas. Sin embargo, las leptospiras se pueden identificar en el microscopio mediante la prueba de anticuerpos fluorescentes (PAF). La dificultad para diferenciar la infección subclínica de la asociada con enfermedad requiere evaluar:
- Los registros. Estudiar los niveles de abortos, repeticiones, nacidos muertos, neonatos débiles y la edad de inicio de la enfermedad en cerdas y cerdas primerizas.
- Estudiar el cuadro clínico.
- Descartar otras enfermedades.
- Descartar las causas no infecciosas de infertilidad.
Obtener muestras de los animales sospechosos y repetirlas al cabo de 2-3 semanas. Buscar títulos crecientes de anticuerpos, como por ejemplo: resultado de la primera muestra 1:100, segunda muestra 1 :800. Estos resultados confirmarían la presencia de infección activa e indican compromiso probable. - Obtener muestras de sangre de 1 O hembras con antecedentes de infertilidad.
- Sin embargo, en la enfermedad crónica, es muy difícil interpretar la relevancia de los títulos.
- Evaluar mediante PAF los fetos abortados, la orina o los riñones y trompas de Falopio de cerdas primerizas sacrificadas.
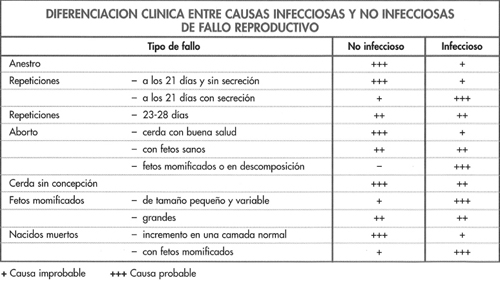
Los síntomas de leptospirosis se pueden confundir con otras causas de infertilidad como:
PRRS crónico.
Endometritis.
Causas no infecciosas.
Infertilidad de verano.
Fallos del manejo.
La lectura del capítulo 5 y la figura 6-1 aportan información para diferenciar estas enfermedades.
Tratamiento
- Medicar el pienso con tetraciclinas, oxitetraciclina o clortetraciclina, en niveles de 800 g/tonelada. Administrar este pienso durante 3 semanas y repetir el tratamiento al cabo de 6 semanas. Este esquema se debe repetir en cuatro períodos de tratamiento.
- Una serie inicial de 3 semanas de durac1on con 800 g de tetraciclina seguida por otra con 400 g durante 8 semanas.
- Medicación estratégica. Si la granja tiene antecedentes de infertilidad periódica, el pienso medicado se puede administrar inmediatamente antes del período de enfermedad anticipado.
- Inyectar a las cerdas en el destete con 25 mg/kg de estreptomicina. Administrar este fármaco a los verracos 1 vez cada 6 semanas. Si no se dispone de estreptomicina, se pueden emplear penicilinas semisintéticas.
- Introducir antibiótico en la región anterior de la vagina después de la cubrición . Este pro.cedimiento es similar al descrito para las secreciones vaginales y consiste en emplear un cat~~er de IA para depositar el antibiótico en la ~eg1on a~t~rior de la vagina 6-18 horas despues de la ultima cubrición. Se puede emplear ampicilina, amoxicilina o penicilina/dihidroestreptomicina (véase el cap. 15). Considerar el tratamiento con el veterinario.
- El control mediante vacunación tiene una eficacia razonable y muchos países disponen de vacunas que contienen cinco o seis tipos de, leptospiras. Si no se dispone de vacunas, sera necesario recurrir a la antibioterapia.
- A pesar de la dificultad para prevenir las infecciones por L. bratislava/muenchen en la granja, los tipos más graves como L. tarassovi y L. pomona se pueden mantener fuera de la granja mediante el aislamiento estricto del plantel de reposición, evaluación serológica, con~ultas con el veterinario y conociendo la gran1a de origen.
- Si se identifican leptospiras activas en la gran1a, la higiene, la eliminación constante de la orina y un manejo correcto se convierten en métodos de control importantes. En las granjas que se mantienen en el exterior, los revolcaderos se pueden convertir en fuentes de contaminación, especialmente si tienen depósitos de orina fresca. El método de control más eficaz es contar con dos revolcaderos por corral y utilizar una cerca electrificada la cual mediante el movimiento permitirá el vaciado y secado de cada uno alternativamente.
- Las superficies de cemento no adecuadas que permiten la acumulación de orina y agua en las unidades cerradas son fuentes ideales para mantener niveles elevados de infección.
- Si la cerda sólo se expone a un bajo número de microorganismos, es probable que se produzca infección con enfermedad leve.
- Verificar si el diagnóstico de enfermedad es correcto.
- Comprobar el estado serológico de la granja. No comprar animales sin control.
- Controlar las fuentes de verracos y cerdas primerizas.
- Mantener el control de los roedores.
- Contar con superficies de cemento con buen drenaje, especialmente en las áreas de defecación y en los corrales de verracos.
- Eliminar el purín con regularidad.
- Identificar los ciclos con problemas y proceder a la medicación estratégica.
- Aplicar vacunas, si están disponibles.
Si bien es posible implementar procedimientos de erradicación, no son totalmente eficaces y podrían estar contraindicados para L. bratislava.

 © 2000 - 2021. Global Ag MediaNinguna parte de este sitio puede ser reproducida sin previa autorización.
© 2000 - 2021. Global Ag MediaNinguna parte de este sitio puede ser reproducida sin previa autorización.