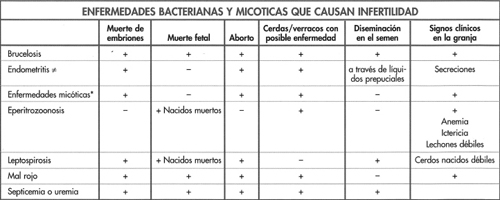
Infertilidad vírica
ENFERMEDAD DE AUJESZKY /VIRUS DE LA PSEUDORRABIA (EA O PR)
Para más información consulte el capítulo 12.
Esta es una enfermedad porcina importante causada
por un herpesvirus. Una vez introducido en la
granja, el virus se suele mantener y puede afectar
continuamente la función reproductiva a diferentes
niveles. El virus puede sobrevivir hasta 3 semanas en
el medio ambiente.

Enfermedad aguda
Los episodios agudos de la enfermedad se producen cuando las cepas virulentas del virus infectan por primera vez a una granja susceptible no vacunada. El virus atraviesa el útero y la placenta e infecta al feto. Con frecuencia, los primeros signos clínicos son abortos, nacidos muertos y camadas débiles que mueren pronto. Los abortos pueden aumentar al 5% durante un período de alrededor de 6 semanas seguido por disminución de la eficacia en todas las etapas del ciclo reproductivo. Los embriones mueren y son absorbidos y las cerdas retornan al estro. Estos problemas reproductivos pueden afectar hasta al 20% de las cerdas gestantes. Sin embargo, estos no son los únicos signos clínicos observados en la granja. Estos virus pueden infectar a los perros y el ganado, que presentan signos neurológicos y mortalidad.
Cuando una granja no vacunada atraviesa la fase aguda inicial de la enfermedad y desarrolla inmunidad, los signos clínicos son esporádicos y más leves y, debido a su naturaleza insidiosa, es difícil asociarlos con un problema de infertilidad. La reducción de todos los parámetros de eficacia reproductiva es una característica de la infección crónica que se asocia con niveles incrementados de repeticiones de celo, momificación, nacidos muertos y mortalidad en los lechones. Las hembras jóvenes portadoras que sufren estrés eliminan virus que mantienen la infección en la granja. La diseminación de la infección en la explotación es baja y los niveles de inmunidad e infección aumentan y disminuyen durante ciclos de 1 o 2 años.
Estado portador
Después de la fase aguda, los signos clínicos de enfermedad pueden desaparecer por completo, co-
mo ocurre con frecuencia en granjas pequeñas con menos de 100 cerdas. A veces el virus puede desaparecer por sí mismo. Sin embargo, es más común hallar persistencia esporádica en pocos animales.
Métodos de diseminación entre granjas
- Movimiento de cerdos portadores.
- Aéreo -por lo menos 3 km.
- Infección a partir de cerdos silvestres o jabalíes .
- El papel de la diseminación mecánica a través de las aves es cuestionable.
- Canales contaminadas.
- Por vía mecánica a través de personas.
- Vehículos contaminados.
- Semen infectado en una inseminación artificial (IA) o en un verraco portador.
- Camada infectada.
Cuando una granja reproductora susceptible sufre el primer episodio de esta enfermedad, los signos clínicos descritos sugieren enfermedad de Aujeszky y son prácticamente diagnósticos. Es necesario realizar estudios de laboratorio para confirmar el diagnóstico. Los estudios más frecuentes son:
- Pruebas de anticuerpos fluorescentes en tejidos de lechones muertos, en especial las tonsilas. Estas pruebas son fiables y los resultados están disponibles en pocas horas.
- Aislamiento e identificación del virus del pulmón y las tonsilas. Esta prueba es lenta y retrasa varios días pero se puede realizar como confirmación adicional del diagnóstico.
- Los estudios en sangre (serología) para demostrar elevación de los niveles de anticuerpos se retrasan demasiado tiempo, por lo cual no son útiles.
El primer episodio de EA en una explotación susceptible se puede confundir con muy pocas enfermedades, excepto la peste porcina. La enfermedad crónica se puede confundir con PRRS y peste porcina crónica. Los estudios de laboratorio son necesarios para diferenciarlas.
Tratamiento
- No existe tratamiento disponible, pero se puede considerar la antibioterapia con objeto de controlar el desarrollo secundario de bacterias en un nuevo brote, como:
- 600-800 g de CTC u OTC en la ración de los animales reproductores durante 3-4 semanas, de acuerdo a las indicaciones del veterinario.
- Vacunación. Esta es la acción clave. En cuanto se ha identificado la enfermedad todo el stock reproductivo debe recibir una vacuna con deleción de genes, que mitiga los efectos y reduce la diseminación del virus.
- No se debe permitir el desarrollo de EA (PR) .
- Comprar cerdas primerizas y verracos sólo en granjas con estado de salud conocido y vacunarlos antes de su llegada o en la cuarentena.
- Comprar cerdas primerizas y verracos sólo en granjas con estado de salud conocido y vacunarlos antes de su llegada o en la cuarentena.
- Mantener el stock reproductor adquirido aislado de la granja para realizar estudios de sangre antes de incorporarlo a la t:xpiotación.
- Comprar reproductoras sólo en granjas libres de EA.
- Si la granja tiene riesgo de EA, es decir que se encuentra dentro de un radio de 3 km de distancia de grandes granjas infectadas, se la debe vacunar para prevenir la enfermedad .
- La vacunación ayuda a prevenir el establecimiento del virus.
- En las granjas con EA se deben adoptar las estrategias para eliminar la enfermedad (cap. 12).
VIRUS DE LA DIARREA VIRICA BOVINA (DVB) Y VIRUS DE LA ENFERMEDAD DE BORDER (EB)
Estos dos virus pertenecen al mismo grupo de pestivirus que el virus de la peste porcina, infectan en especial al ganado bovino y ovino respectivamente, pero pueden causar problemas reproductivos en granjas de cría. Estos problemas consisten en bajas tasas de concepción, pocos abortos, muerte y momificación fetal, camadas pequeñas y nacidos con poco peso. Rara vez causan otros signos clínicos en los cerdos. Estas enfermedades no son causas frecuentes de infertilidad porcina y tienen una ubicación baja en el listado de diagnósticos diferenciales. La infección se introduce en la granja debido a exposición a heces de ganado bovino u ovino, alimentación con leche de vaca no pasteurizada o vacunas contaminadas con virus atenuados-vivos. Estas infecciones no tienen tratamiento y se autoeliminan.
VIRUS DE LA PESTE PORCINA CLASICA (PPC) - VIRUS DEL COLERA PORCINO (CP)
Para más información consulte el capítulo 12.
La peste porcina es un virus miembro de la familia de pestivirus. El cerdo es el único hospedador natural. El virus es muy contagioso y se disemina a través de las secrecio nes nasales y bucales, la orina y las heces de cerdos infectados o portado res. La infección ingresa a través de la boca mediante contacto directo entre cerdos. Se transmite en la granja debido a la introducción de un cerdo portador o de carne infectada. El virus sobrevive durante períodos prolongados en canales conge ladas.
Signos clínicos
Cuando el virus se introduce en la granja reproductora, causa inapatencia y fiebre alta. Puede atravesar la placenta causando muerte y momificación fetal, abortos, malformaciones y aumento de los nacidos muertos. Una característica importante es el nacimiento de lechones muy débiles con temblor similar al temblor congénito. Sin embargo, en el temblor congénito las hembras reproductoras no presentan signos clínicos de enfermedad. Los animales afectados pueden presentar convulsiones y muerte al cabo de pocas horas y las cerdas pueden perder la función de los miembros. La enfermedad aguda produce efectos espectaculares sobre la reproducción.
Diagnóstico
La PPC tiene diseminación rápida y causa mortalidad elevada. Produce cambios característicos postmortem con ganglios linfáticos hemorrágicos, placas necróticas en el bazo, hemorragias pequeñas múltiples en los riñones y las denominadas "úlceras en botón" en el intestino . Todas estas características tienen re levancia clínica. Los estudios de laboratorio incluyen: identificación del antígeno vírico, aislamiento del virus e identificación de anticuerpos séricos. En la mayor parte de los países la PPC es una enfermedad de declaración obligatoria.
Tratamiento
No existe tratamiento para esta enfermedad.
Prevención
El virus de la PPC es muy persistente y sobrevive en tejidos congelados durante períodos prolongados. Muchos países tienen programas de sacrificio de los animales afectados y erradicación de la enfermedad. En regiones con brotes diseminados de la enfermedad a veces se recurre a la vacunación para controlar la diseminación, seguida por políticas de sacrificio de los animales.
VIRUS DE LA ENCEFALOMIOCARDITIS (VEMC)
El principal reservorio de este virus es la rata aunque el ratón también puede diseminarlo. Causa infección y enfermedad en una amplia variedad de animales vertebrados, pero los cerdos parecen ser las especies más susceptibles entre los animales de granja. El virus tiene dist ribución mundial pero su patogenicidad y virulencia varían entre diferentes países y regiones. En la mayoría de los países europeos, en especial los pertenecientes a la Unión Europea (UE), tiende a causar una cuadro clínico relativamente leve o no es patógeno y la enfermedad rara vez se diagnostica en cerdos.
Las cepas de Australia parecen ser mucho más virulentas para los cerdos que las de Nueva Zelanda. Las cepas virulentas presentes en Florida, el Caribe y probablemente América Central causan lesiones cardíacas y muerte mientras que las del mediooeste de los EE.UU. tienden a producir problemas reproductivos. La enfermedad clínica porcina tiende a manifestarse cuando el número de ratas incrementa hasta alcanzar niveles de plaga. Los cerdos se pueden infectar a partir de ratas y de pienso o agua contaminados porratas. La diseminación entre cerdos no parece ser rápida.
Signos clínicos
Los primeros signos suelen consistir en pocos abortos al final de la gestación en cerdas primerizas y cerdas. A continuación, durante un período de alrededor de 3 meses aumenta el número de fetos momificados y nacidos muertos, así como la mortalidad antes del destete. La tasa de parto disminuye. Las hembras afectadas pueden atravesar una fase de fiebre y anorexia. Los lechones destetados y en crecimiento de las granjas afectadas no suelen presentar signos clínicos.
Diagnóstico
Para establecer el diagnóstico definitivo es necesario aislar e identificar el virus o documentar la elevación de los títulos de anticuerpos en muestras de sangre obtenidas con un intervalo de 2 semanas.
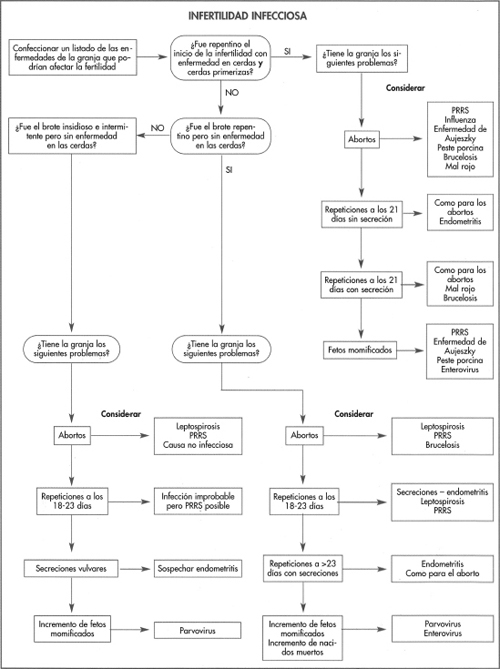
Enfermedades similares
La EMC se puede confundir con EA, PVP y PRRS, aunque como se observa en la figura 6-2 existen signos diferenciales entre estas cuatro enfermedades. El VEMC es el último del listado de prioridades diagnósticas en Europa, pero en menor grado en el mediooeste de los EE.UU. El aborto o la enfermedad en cerdas o lechones debido a PVP es infrecuente y el examen de los fetos momificados permite hallar evidencias de esta infección.
Tratamiento
No existen métodos de tratamiento disponibles.
Control del manejo y prevención
- Buscar cepas patógenas en el stock reproductor de reposición.
- Se ha documentado la eficacia de vacunas con virus inactivados en algunos casos.
ENTEROVIRUS (SMEDI)
Estos virus tienen origen intestinal, su hospedador específico es el cerdo y se describen con la sig la SMEDI (nomenclatura inglesa correspondiente a los térmi y mediante la demostración de cuerpos de inclusión en cortes de tejido.
Enfermedades similores
La enfermedad se puede confundir con rinitis atrófica o infección nasal por Bordetella, aunque los efectos son de muy corta duración y no causan atrofia progresiva ni distorsión de la nariz. La rinitis por CMVP sólo afecta a lechones recién nacidos y existe la tendencia a presumir que los estornudos en lechones se deben asociar con rinitis atrófica. La rinitis es la inflamación de los delicados tejidos de la nariz y se debe a polvo, gases, bacterias, virus o a cualquier material irritante. La infección por Pasteurella multocida productora de toxinas causa inflamación persistente con lesión y destrucción progresiva de los tejidos (atrofia); es una enfermedad grave. Se puede diferenciar de la infección por CMVP mediante hisopos nasales obtenidos de lechones con estornudos y valorando la presencia o ausencia de Pasteurella. Estas medidas son importantes porque si los estudios son negativos, los signos clínicos no deben plantear preocupación (y tampoco es necesario iniciar tratamientos costosos).

Tratamiento
- No es necesario.
- Si se observan estornudos o crecimiento lento después del destete, el lechón se puede medicar con antibióticos como CTC, OTC, trimetoprim/ sulfa o tilosina durante 14 días.
- Garantizar buenas condiciones ambientales en las instalaciones destinadas al parto y a lechones lactantes.
- Evitar las fluctuaciones de la temperatura.
- Evitar el polvo.
- Mantener un manejo de todo dentro/todo fuera en las salas de parto.
PARVOVIRUS PORCINO (PVP)
Es la causa más común e importante de infertilidad infecciosa. El PVP es un virus bastante resistente que en condiciones normales se replica en el intestino del cerdo sin causar signos clínicos. Tiene una distribución amplia en todo el mundo. Su presencia es casi invariable cuando se investiga en la granja. Por lo tanto, esta infección requiere medidas de control durante toda la vida. Mientras que la mayor parte de los virus no sobreviven fuera del hospedador durante períodos prolongados, el PVP tiene la característica no habitual de que puede persistir fuera del cerdo durante muchos meses y es resistente a la mayoría de los desinfectantes. Esto podría explicar su amplia distribución y la dificultad para eliminarlo del medio ambiente porcino. Para comprender el papel del PVP en la reproducción es importante recordar que la infección reproductiva suele evolucionar sin enfermedad, aunque en algunas ocasiones causa enfermedad reproductiva. El PVP se transmite por vía bucal o nasal, pasa al intestino, donde se replica y luego se elimina en las heces. La primera infección en cerdas no gestantes no produce signos clínicos. Sin embargo, en cerdas gestantes expuestas durante los primeros 55 días de la gestación, el virus atraviesa la placenta y causa la muerte selectiva de los lechones. En el feto infectado antes de los 35 días de edad, y antes del desarrollo óseo, produce muerte seguida por reabsorción completa y nacimiento de una camada pequeña. Si la infección se produce entre los días 30 y 55 de la gestación causa muerte y momificación fetal. No todos los casos de momificación se deben a infección por PVP, ya que esta situación no es frecuente . La primera infección por PVP se retrasa de 1 O a 14 días en afectar a los fetos. A partir de los 70 días de gestación el sistema inmunitario fetal ya ha comenzado su desarrollo y puede responder y proteger al feto del virus. Por lo tanto, si las hembras gestantes sufren una primera infección alrededor del día 55 de la gestación, se hallarán pocas evidencias de enfermedad. Esto se diferencia de la infección por PRRS, que causa muerte intrauterina sólo después de los 70 días de gestación y por lo tanto, produce momificación fetal muy tardía. Una vez que alcanzó el útero, el PVP se disemina con lentitud desde un feto a otro y por lo tanto, los tamaños de los fetos momificados varían dentro de la misma camada.
Signos clínicos
Brotes agudos de la enfermedad
La infección no causa otros síntomas clínicos aparte de momificación fetal. Los brotes agudos de la enfermedad producen:
- Camadas pequeñas asociadas con pérdida de embriones antes de los 35 días.
- Fetos momificados de tamaño variable (30-160 mm).
- Mayor número de nacidos muertos, que se asocia con el retraso del mecanismo del parto debido a la presencia de fetos momificados.
- Los abortos son infrecuentes.
- La infección puede causar mayor número de lechones nacidos con poco peso pero no incide sobre la mortalidad neonatal.
- El episodio agudo suele durar hasta 8 semanas y luego declina durante 4-6 semanas, seguido
- por temporadas más breves de fetos momificados durante otras 4-6 semanas.
- El virus se puede retrasar hasta 4 meses en infectar a todas las cerdas de una granja susceptible sin infección previa.
Se observa en hembras individuales o infectadas por primera vez. Por lo general se limita a las cerdas primerizas.
Registros
Los registros pueden contribuir en el diagnóstico de enfermedad por PVP y las diferencias entre granjas sanas y enfermas se presentan en la figura 6-4. Cuando los brotes agudos de la enfermedad comprometen a muchos animales de la granja, el tamaño de la camada disminuye y el porcentaje de camadas con menos de 9 lechones incrementa desde alrededor del 10% hasta el 40%. El número de lechones momificados, en especial asociado con camadas pequeñas incrementa y las cerdas sin concepción pueden incrementar del 2 al 6%. Esto se debe a la reabsorción total del embrión antes de los 35 días o a muerte fetal completa y pseudogestación. En algunos casos, la cerda alcanza el momento del parto con un desarrollo normal de las mamas, aun hasta el grado de producir leche, pero no pare nacidos vivos. Una inyección de prostaglandina para desencadenar el parto obtiene los lechones momificados que se hallaban dentro del útero. Estos animales no parirían de otra manera porque el parto se desencadena en presencia de fetos vivos. Este cuadro se observa sólo a este nivel en una granja susceptible (definida por un 50-70% de hembras reproductoras seronegativas). Es probable hallar estos episodios cada 3 a 4 años en granjas no vacunadas, ya que la circulación de virus decae y aumenta. Durante los períodos de actividad baja o ausencia del PVP se produce la emergencia gradual de una población susceptible.
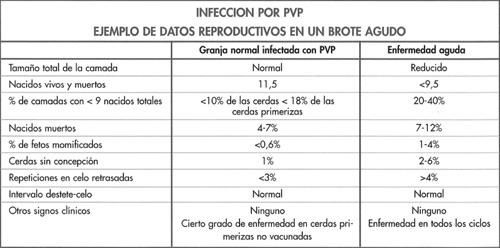
La infección por PVP produce niveles elevados de anticuerpos séricos que persisten durante períodos prolongados. Se debe apreciar que estos niveles no siempre indican un problema reproductivo actual o previo o un nivel de protección más elevado. Por ejemplo, un título de 1 :2 confiere la misma protección que uno de 1 :80.000. La obtención de muestras de sangre de todas las cerdas sólo indica el porcentaje actual de animales con exposición previa al parvovirus y aporta una idea acerca de la inmunidad o la susceptibilidad global de la granja de cría. Todo animal expuesto al PVP se mantiene inmunizado por el resto de su vida. Desde una perspectiva práctica, la granja de cría puede hallarse en una de tres fases .
- Seronegativa. Todas las hembras son muy susceptibles a la infección y a sufrir problemas reproductivos. Esta situación no es habitual pero se observa en algunas granjas pequeñas, de las cuales el virus puede desaparecer. Si el parvovirus se introduce en estas granjas desencadenará un brote masivo de enfermedad reproductiva; repeticiones, fetos momificados, reabsorción de embriones y posiblemente algunos abortos. Estas granjas se deben vacunar de inmediato.
- Infección endémica. El PVP tiene una circulación continua y el 50-90% de los animales está inmunizado. Sin embargo, todo animal seronegativo puede tener infección durante la fase inicial o media de la gestación y por lo tanto existe una cantidad variable de infección. Este era el cuadro típico en grandes granjas no vacunadas antes de la disponibilidad de vacunas. Se producen brotes intermitentes de enfermedad que afectan especialmente a cerdas primerizas y hembras de segundo parto. A medida que la actividad vírica incrementa, también aumenta la inmunidad en la
| TITULOS SERICOS PARA PVP | |
| Nivel/ relevancia | |
| Hembra no vacunada | Negativo- Susceptible a la infección y al fallo reproductivo |
| Hembra vacunada | 1:2a1:160 Protegido |
| Cerda primeriza con anticuer-pos maternos | 1:4a1 :320 Protegido pero disminuirán |
| Inmunidad activa | >1:640 Protegido |
- granja. Cuando el número de animales inmunizados es elevado, la incidencia de infección disminuye y la inmunidad de la granja va diminuyendo gradualmente a medida que se seleccionan las cerdas inmunizadas de mayor edad.
- Enfermedad en cerdas primerizas de reposición. Esta situación es frecuente porque por lo menos el 50% de las cerdas primerizas pueden no haber estado expuestas al PVP hasta el momento de la cubrición, por lo cual son susceptibles. Hasta un tercio de estos animales se puede infectar en la primera mitad de la gestación y sufrir problemas reproductivos.
- El virus se disemina en todas las poblaciones porcinas pero puede desaparecer de las granjas pequeñas (<100 cerdas).
- La infección es endémica (presente todo el tiempo) en la mayor parte de las unidades porcinas.
- La exposición confiere inmunidad durante toda la vida.
- Los problemas reproductivos pueden aparecer cada 3-4 años en una granja no vacunada.
- La infección por parvovirus en una hembra susceptible puede causar muerte del embrión seguida por reabsorción o muerte y momificación fetal.
- Por lo tanto, los signos principales son: camadas pequeñas, fetos momificados de diferentes tamaños, aumento de las pseudogestaciones y cerdas sin concepción.
- El PVP es una causa infrecuente de aborto.
- La inmunidad materna puede persistir hasta los 7 meses de vida pero sólo en algunas cerdas primerizas. (Esto interfiere con la respuesta a la vacuna.)
- Hasta el 50% de las cerdas primerizas pueden ser seronegativas en la cubrición.
Puntos clave para reconocer la enfermedad por PVP
- Camadas pequeñas asociadas con fetos momificados de tamaños variables en especial en cerdas primerizas no vacunadas o vacunadas mientras están protegidas por los anticuerpos maternos.
- Mayor porcentaje de repeticiones de celo.
- Ningún otro signo de enfermedad en hembras reproductoras o en animales afectados individuales.
- Algunas cerdas primerizas o cerdas llegan hasta el parto pero no producen lechones vivos.
- Ningún programa de vacunación previo en las cerdas primerizas.
- Examinar con cuidado todos los productos del parto para detectar fetos momificados pequeños de tamaño variable.
- Enviar todos los fetos momificados (<150 mm) de las camadas pequeñas a un laboratorio para realizar pruebas con anticuerpos fluorescentes. Esto confirmará si la mortalidad fetal se debe a infección por PVP.
Un brote agudo se puede confundir con enfermedad de Aujeszky (EA, PR), PRRS, leptospirosis o ciertas formas de influenza, pero la infección por PVP no produce otros signos clínicos en las reproductoras, los neonatos son sanos con actividad plena y los abortos son escasos o no se producen. Esto se puede confundir con SMEDI debido a infección por enterovirus, pero este cuadro es muy poco frecuente y los estudios de laboratorio pueden diferenciar ambas enfermedades.
Tratamiento
No existe tratamiento disponible.
Control del manejo y prevención
- Ante un brote agudo, se debe vacunar de inmediato a las reproductoras para prevenir la infección en animales seronegativos. Considerar estas medidas con el veterinario. Recordar que el efecto de la primera dosis de vacuna se manifi esta al cabo de 1 O días.


- Una sola dosis de vacuna estimula el sistema inmunitario de la cerda primeriza y produce un bajo nivel de anticuerpos (1 :64). La vacunación y la estimulación de la inmunidad por la infección natural es suficiente para proteger a la camada de la enfermedad. La infección por PVP se retrasa 1 0-14 días en atravesar la placenta e infectar a los embriones o fetos. Si la hembra reproductora infectada ya fue vacunada, la exposición al PVP produce reestimulación rápida del sistema inmunitario (5-7 días). Esto basta para prevenir la enfermedad y estimular una inmunidad permanente. La figura 6-5 muestra los niveles de enfermedad en 69 granjas durante un período de 1 O años, antes de la vacunación y durante un período de 8 años después de una sola inyección de vacuna Suvaxyn Parvo sólo a las cerdas primerizas. Estos resultados demuestran que es posible controlar la enfermedad mediante una dosis única de vacuna aun cuando las pruebas serológicas han demostrado que la circulación de PVP se mantiene en todas las granjas. Considerar la política de vacunación con el veterinario. La situación puede variar si se aplican dos dosis de vacuna seguidas por uno o dos refuerzos anuales.
No es posible erradicar el parvovirus de una granja.
SINDROME REPRODUCTIVO Y RESPIRATORIO PORCINO (PRRS)
El PRRS se debe a un virus aislado y clasificado como arterivirus en 1991. El síndrome se reconoció a mediados de la década del '80 en los EE.UU. y se denominó enfermedad misteriosa de los cerdos o enfermedad de la oreja azul. El virus del PRRS tiene afinidad por los macrófagos, en especial por los pulmonares. Los macrófagos son parte de las defensas corporales, ya que ingieren y eliminan las bacterias y virus invasores. Los presentes en el pulmón se denominan macrófagos alveolares. A diferencia de sus efectos sobre la mayor parte de las bacterias y virus, los macrófagos no destruyen al virus del PRRS, que se multiplica dentro de ellos y los elimina. El virus destruye hasta el 40% de los macrófagos. Esto elimina un componente importante del mecanismo de defensa corporal y permite la proliferación y la infección por bacterias y otros virus. Un ejemplo común de esta situación es el incremento notorio de la gravedad de la neumonía enzoótica en unidades de engorde/cebo infectadas con el virus del PRRS. Otro ejemplo es el incremento alarmante de casos clínicos de meningitis en granjas con Streptococcus suís virulento tipo 2 enzoótico. Los investigadores han empleado esta observación en la reproducción experimental de la meningitis estreptocócica. Una vez que el virus del PRRS ha ingresado en la granja, tiende a mantenerse activo por tiempo indefinido. La persistencia del virus en la granja se relaciona con numerosos factores:
- La introducción regular de cerdas primerizas seronegativas susceptibles puede favorecer la persistencia del virus en la granja.
- La infección en lechones recién destetados, transmitida desde grupos infectados de mayor edad, se mantiene después de la desaparición de los anticuerpos maternos. De esta manera, la enfermedad respiratoria enzoótica activa se perpetúa en muchas granjas.
- Producir la primera infección en todo el stock reproductor puede requerir hasta 1 año, especialmente en granjas grandes. Aunque el virus parece tener diseminación rápida, pueden pasar 4 a 5 meses antes de que no menos del 90% de las cerdas se vuelvan seropositivas. Además, no es infrecuente que 1 a 2 años después de la infección las granjas de cerdas tengan menos del 20% de animales seropositivos. No obstante, esto no siempre indica pérdida de la inmunidad o de la transmisión de inmunidad a su descendencia.
El virus se disemina a través de las secreciones nasales, la saliva, las heces y la orina y los estudios de campo indican que está .pres.ente en el aire en un radio de hasta 3 km (2 millas).' El estado portador en el cerdo puede durar 2 a 3 meses. En algunos individuos puede tener una permanencia más prolongada aunque no eliminen virus. La inseminación artificial (IA) podría ser un método de diseminación si se emplea semen de animales con viremia y en especial durante el período inicial de 3 a 4 semanas posterior a un brote en un centro de IA. Fuera de este período, las evidencias de campo indican que el riesgo de diseminación en el semen es muy bajo en grupos de
verracos con infección previa. En un estudio de 3 años de duración, 5 granjas grandes PRRS negativas recibieron 32.000 dosis de IA provenientes de un centro de IA compuesto por verracos de granjas positivas. No se produjo infección ni seroconversión. Los animales adultos excretan virus durante períodos mucho más breves (14 días) que los cerdos en crecimiento que pueden excretarlo durante 1 a 2 meses.
Los métodos comunes de diseminación son:
- Movimiento de cerdos portadores.
- Transmisión a través del aire en un radio de hasta 3 km.
- Transmisión mecánica a través de las heces, polvo, gotitas y equipamiento contaminado.
- Botas y vestimentas contaminadas.
- Vehículos, en especial en clima frío.
- Inseminación artificial pero sólo si el verraco tiene viremia. Este período parece durar sólo 3- 4 días.
- A través de patos silvestres y probablemente aves de otras especies.
Signos clínicos
El cuadro clínico puede variar en gran medida entre granjas. Como guía, por cada tres granjas expuestas a PRRS por primera vez una de ellas no presentará enfermedad reconocible, la segunda presentará enfermedad leve y en la tercera la enfermedad será moderada a grave. Las causas de esta distribución aún no se han definido. Sin embargo, cuanto mejor sea el estado de salud de la explotación, menos graves serán los efectos de la enfermedad. Es posible que el virus sufra mutaciones continuas durante la multiplicación, lo cual elimina algunas cepas muy virulentas y otras que no lo son. Se ha observado una tendencia a que todas las infecciones víricas epizoóticas reduzcan su virulencia (por ej., peste porcina africana y mixomatosis del conejo). Las observaciones de campo también sugieren que el virus destruye los macrófagos y así reduce la inmunidad porcina. La gravedad del brote depende en cierta medida de la presencia de otros virus y bacterias en la granja y de su capacidad para causar enfermedad. Además, cuando la inmunidad porcina está comprometida, la densidad excesiva del stock y la calidad del medio ambiente son factores importantes. Por ejemplo, la infección por PRRSV en un cerdo con enfermedad mínima no causa neumonía detectable pero si el animal ya estaba infectado con patógenos respiratorios y su medio ambiente es inadecuado, puede inducir el desarrollo de enfermedad grave persistente.
Enfermedad aguda
Cuando el virus ingresa por primera vez a la granja, la enfermedad afecta a cerdas gestantes, cerdas en lactación y a lechones lactantes.
Signos clínicos en cerdas gestantes durante el primer mes de la infección
- Períodos breves de inapetencia durante 7-14 días -1 0-15% de las cerdas al mismo tiempo.
- La temperatura corporal puede aumentar a 39- 40ºC (103-105ºF).
- Abortos, generalmente tardíos - 1-6%. Estos suelen ser los primeros signos observados.
- Cambio transitorio de la coloración de las orejas (2%, enfermedad de oreja azul).
- Algunas cerdas tienen partos ligeramente prematuros -10-15% durante las primeras 4 semanas del brote.
- Incremento del retorno del celo 21-35 días después de la cubrición.
- Anestro prolongado ,y retorno del celo retrasado después del destete.
- Tos y signos respiratorios.
- Coloración azulada transitoria de las orejas.
Signos clínicos en cerdas paridoras en el primer mes de infección
- Inapetencia durante el período del periparto.
- Renuencia a beber.
- Agalaxia y mamitis.
- Los partos se adelantan 2 a 3 días.
- Cambio de coloración de la piel y úlceras por presión asociadas con vesículas pequeñas.
- Letargia.
- Signos respiratorios.
- Fetos momificados. Puede haber mortalidad del 10-15% de los fetos durante las 3-4 semanas finales de la gestación.
- Aumento de nacidos muertos hasta el 30%.
- Nacimiento de lechones muy débiles.
bre se suele retrasar 3-6 semanas en manifestarse en la granja. La cianosis o coloración azulada de las orejas es un hallazgo variable y afecta a menos del 5% de las cerdas. Este cambio es transitorio y puede durar sólo algunas horas. Algunas cerdas tienen tos y se pueden hallar pocos casos de neumonía clínica. Esta fase aguda dura hasta 6 semanas en la granja y se caracteriza por partos prematuros, incremento de nacidos muertos, de lechones débiles y de fetos grandes momificados que han muerto durante las últimas 3 semanas de gestación. Estas características pueden afectar hasta al 30% de los lechones nacidos en algunas granjas. La mortalidad de los lechones llega al 70% en las semanas 3 a 4 posteriores al inicio de los síntomas y sólo retorna a los niveles preinfección al cabo de 8-12 semanas. Los problemas reproductivos pueden persistir durante 4-8 meses antes del retorno a la normalidad, pero algunas granjas pueden mejorar hasta el nivel pre-PRRS.
Efectos a largo plazo
Es difícil valorar los efectos a largo plazo del PRRS sobre la eficacia reproductiva, especialmente en granjas con mal estado de salud. Algunas presentan incremento en las repeticiones, secreciones vulvares y abortos, que se atribuyen al PRRS. Los estudios de campo han observado efectos del PRRS sobre la eficacia reproductiva en granjas con infección enzoótica hasta 1 2 meses después del establecimiento de la enfermedad. Estos efectos son:
- Reducción del 10-15% en la tasa de partos (90% de las granjas retornan a la normalidad).
- Menor número de nacidos vivos.
- Aumento de nacidos muertos.
- Bajas tasas de reproducción en cerdas primerizas.
- Partos prematuros.
- Incremento de los abortos (2-3%).
- Inapetencia de las cerdas durante el período del parto.
Signos en verracos
- Inapetencia.
- Aumento de la temperatura corporal.
- Letargia.
- Pérdida de la libido.
- Reducción de la fertilidad.
- Camadas pequeñas.
- Baja producción de semen.
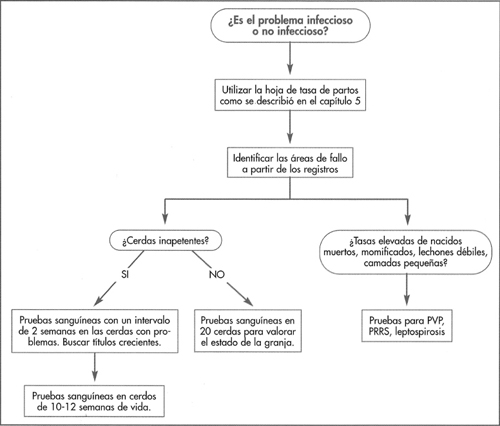
Si la granja no se ha expuesto al virus del PRRS, la obtención de muestras de sangre de un mínimo de 12 animales adultos (preferiblemente de aquellos que rechazaron el pienso durante no menos de 3 semanas) es un método diagnóstico fiable. Los estudios serológicos disponibles incluyen la prueba de revestimiento o IPMA, la prueba de anticuerpos inmunofluorescentes y una prueba ELISA. Estos estudios pueden obtener resultados falsos positivos o falsos negativos en animales individuales, pero son fiables en grupos para determinar si la granja está infectada. Cuando la enfermedad persiste, las muestras de sangre se deben examinar en un intervalo de 2 semanas para establecer si el virus se asocia con un problema clínico en particular. Algunos países disponen de pruebas de PCR en muestras de sangre pequeñas obtenidas en la fase aguda inicial.
Enfermedades similares
Cuando el virus del PRRS ingresa por primera vez a la explotación, el cuadro clínico se puede confundir con EA, pero la ausencia de síntomas nerviosos en los lechones y las pruebas serológicas permiten diferenciar ambas enfermedades.
Tratamiento
Aún no se dispone de tratamiento contra las infecciones víricas. Sin embargo, durante la fase aguda del PRRS es indispensable evitar la multiplicación de bacterias que los macrófagos habrían destruido en condiciones normales. Se debe administrar antibioterapia durante 3-4 semanas a todas las cerdas y verracos en cuanto se ha establecido o se sospecha el diagnóstico. Si es necesario, comenzar con ant ibióticos hidrosolubles seguidos por pienso medicado. El tratamiento inmediato suele reducir la incidencia de abortos, nacidos muertos, fetos momificados y partos prematuros causados por infección bacteriana secundaria.
Programa de control para cerdas gestantes durante la enfermedad agudas
- Elevar la temperatura del corral de cerdas a 21 ºC (72ºF).
- Evitar la caída nocturna de la temperatura.
- Evitar las corrientes de aire.
- Medicar el pienso de inmediato con 500 g/tonelada de tetraciclina CTC u OTC.
- Si las cerdas están inapetentes, medicar el agua con CTC u OTC al comienzo.
- Aplicar la medicación a cerdas primerizas y a verracos.
- Mantener este tratamiento durante 4 semanas.
- Incrementar la ingesta de pienso en no menos de 0,5 kg/día durante las 4 semanas.
- Inyectar OTC o penicilina de acción prolongada
Programa de control durante la fase aguda para cerdas en el área de cubriciones
- Aplicar los mismos procedimientos que para las cerdas gestantes.
- No seleccionar ninguna cerda durante las 6 semanas siguientes (por lo menos) para incrementar el programa de cubriciones.

- Aceptar que se producirá una caída del 10-15% en la eficacia y por ello planificar un aumento del programa de cubriciones contando con más cerdas primerizas y reteniendo las cerdas que se habrían seleccionado.
- Si es posible, comprar cerdas primerizas de una granja con exposición previa, la mayoría o todas estarán inmunizadas. Las cerdas primerizas criadas en la explotación se deben exponer a la infección lo antes posible.
- La exposición de las cerdas primerizas al virus se logra trasladándolas durante 3-4 días a corrales de animales destetados o de cebo.
- Considerar la vacunación de las cerdas primerizas de reposición mientras se encuentran aisladas. Solicitar asesoramiento veterinario.
- No someter a las cerdas primerizas a la cubrición hasta que hayan pasado 6 semanas desde la exposición a la infección.
- Utilizar una dosis de IA para cada cubrición natural durante un período de 8 semanas.
- Inyectar antibióticos 2 días antes del parto. Continuarlos durante un período de 6 semanas en las cerdas que mejoraron.
- Repetir al cabo de 3 días o hasta el parto.
- Utilizar preparaciones antibióticas de acción prolongada. La oxitetraciclina o las penicilinas semisintéticas son los agentes de elección.
- Colocar premezclas de antibióticos en el pineso diario de las cerdas. Utilizar CTC, OTC o TMS. (Administrar 15-20 g de una premezcla al 1 0% por día.)
- Continuar este régimen durante 1 0-21 días después del parto.
- Elevar la temperatura de la unidad de parto a 22ºC (75º F).
- Acolchar los corrales con paja, viruta o papel, si es posible.
- Aumentar la temperatura ambiente para los lechones. Continuar el programa descrito durante 4-6 semanas, de acuerdo a los consejos de su veterinario.
- La granja de cerdas no tiene infección y los lechones destetados no tienen signos de infección. En otras palabras, el virus ha desaparecido y el PRRS no representa un problema.
- La granja de cerdas es seronegativa pero existen signos de infección vírica persistente en cerdos en crecimiento. Estos animales muestran títulos crecientes. Esto genera la exposición continua del stock de cría a la enfermedad.
- Las cerdas primerizas negativas se han infectado y diseminan el virus.
- Vacunación, si se dispone de una vacuna.
- Retirar de la granja el grupo de cerdos infectados, en general los que se encuentran en la primera y la segunda etapas de crecimiento, para eliminar el virus.
- Exponer las cerdas primerizas para mantener una granja inmunizada.
En un principio se creyó que la IA no diseminaría el virus de PRRS pero los estudios epidemiológicos han indicado que esta es una fuente importante de diseminación durante la enfermedad aguda. Los verracos pueden permanecer virémicos durante 8-12 semanas después de la infección inicial o convertirse en portadores crónicos. Sin embargo, evidencias sustanciales indican que si los verracos de cría provienen de granjas con seropositividad conocida y se mantienen aislados durante 8 semanas con cerdos centinela negativos y éstos no exhiben seroconversión, el traslado de los verracos al centro de IA tiene una seguridad relativa. No obstante, los verracos seronegativos del centro requieren supervisión estricta para detectar seroconversión y signos de inapetencia o fiebre. Si existen dudas, los traslados de semen se deben interrumpir hasta la seroconversión. Las extensas bases de datos de IA han demostrado que el semen de verracos seropositivos que no eliminan virus no parece transmitir la infección a granjas seronegativas.
Las observaciones de campo muestran que la mayoría. de las hembras de cría se inmunizan y no sucumben a otros episodios de infección. Sin embargo, si el virus continúa circulando en cerdos en crecimiento, algunas cerdas primerizas negativas de reposición contraerán la infección en algún momento . Experiencias de campo realizadas en Inglaterra han demostrado que la reaparición de la enfermedad en granjas reproductoras es infrecuente.
Control del manejo y prevención
Si la granja se encuentra en una región con muy baja probabilidad de infección directa a partir de una granja vecina, es importante realizar estudios serológicos para determinar si esta granja tuvo exposición al virus del PRRS. Si la granja es negativa, se deben considerar las siguientes acciones:
- Comprar la reposición en granjas consideradas libres de PRRS .
- Establecer un sistema de cuarentena para la reposición durante un período mínimo de 8 semanas.
- A medida que los cerdos se colocan en cuarentena, agregar 6 de sus cerdos con estado negativo conocido al stock de reposición.
- Después de 5 semanas de contacto directo, obtener muestras de sangre de los 6 cerdos centinela y de 6 del stock de reposición.
- Comprobar si la granja donante aún se mantiene libre de infección.
- Asegurar que no llegan camiones con otros cerdos a su granja.
- Proveer botas y vestimenta de trabajo a todos los visitantes.
- No tomar prestado el equipamiento de otras granjas de porcinos .
- Revisar la bioseguridad de la granja.
- En las granjas con infección conocida se pueden adoptar una de dos estrategias de reproducción. Si el virus no está circulando puede ser aconsejable comprar cerdas primerizas y verracos de granjas negativas y vacunarlos en aislamiento. Por otra parte, las cerdas primerizas y los verracos se deben comprar de fuentes con infección conocida y aclimatar durante no menos de 6 semanas antes de la cubrición. El método seleccionado depende del desempeño de las cerdas primerizas. Algunos países disponen de vacunas tanto con virus vivos como inactivados y las estrategias de control dependen de su seguridad y eficacia conocidas. Solicitar asesoramiento al veterinario.
Al cabo de un período, el virus puede desaparecer de las poblaciones de cerdas y de cerdos de cebo pero mantenerse endémico en cerdos de 3-12 semanas de edad en la primera y segunda etapa de crecimiento. El estado de PRRS de la granja se puede establecer obteniendo muestras de sangre de cerdas, lechones destetados y de cebo. Si la enfermedad activa sólo se detecta en cerdos en crecimiento de hasta 12 semanas de vida, se los puede retirar de la granja junto con la producción de nuevos animales destetados de las 2 semanas siguientes. Los corrales se deben limpiar, desinfectar y vaciar durante 2 semanas. Este método de despoblación parcial puede eliminar la enfermedad por PRRS. Los cerdos libres de PRRS se pueden obtener de una granja con virus enzoótico y que tiene inmunidad estable con bajo nivel de infección vírica activa. Este proceso de destete temprano segregado (SEW) consiste en retirar los lechones lactantes más grandes de las salas de parto a los 5-1 O días de vida y criarlos en corrales aislados. Sin embargo, este método no es completamente seguro y en algunas ocasiones pueden llegar a infectarse uno o más lechones de una camada. Para reducir esta posibilidad los cerdos sólo deben provenir de madres seropositivas. Para evitar que la infección se propague a todos los cerdos, cada grupo de lechones destetados se debe mantener aislado hasta haber completado la evaluación. La disponibilidad de pruebas PCR está aumentando para esta finalidad y los resultados se obtienen en pocos días. Para mejorar más aún el sistema, las cerdas deberían colocarse en una sala de partos transitoria fuera de la granja (destete temprano medicado [MEW]). El capítulo 3 describe el destete segregado. Las cerdas de g.ranjas estables se pueden someter a histerectomía. La crianza de los lechones con cerdas de una granja PRRS negativa es un método eficaz para desarrollar un stock PRRS negativo. No obstante, se debe recordar que el virus puede atravesar la placenta en cerdas primerizas y cerdas con infección reciente. Por lo tanto, la histerectomía sólo se debe realizar en las cerdas gestantes que se mantuvieron seropositivas durante no menos de 4 meses. La presencia de infección se debe evaluar mediante PCR en cada camada recién nacida. Las cerdas destinadas a ser nodrizas y los lechones nacidos de una histerectomía se deben mantener aislados hasta conocer los resultados de la evaluación. Una granja se puede despoblar, limpiar, desinfectar y repoblar con un stock PRRS negativo. El procedimiento de despoblación es muy complicado y antes de considerarlo se debe investigar cómo se infectó la granja y valorar la posibilidad de reinfecció n. La repoblación no se debe intentar en invierno porque la supervivencia del virus incrementa con el descenso de la temperatura (por ej., 24 horas a 37°C [99º F], 6 días a 20ºC [ 68ºF], 1 mes a 4 ºC [39ºF]). El virus congelado durante períodos prolongados se mant iene estable. El control del virus del PRRS en cerdos destetados y de cebo se describe en el capítulo 9.
VIRUS DE LA INFLUENZA PORCINA (IP)
La IP se debe a numerosos virus de la influenza A que tienen una relación estrecha entre sí y se caracterizan por su capacidad para cambiar su estructura antigénica y crear nuevas cepas. La IP se transmite a través de personas infectadas, cerdos portadores y probablemente a través del aire, aunque esta última vía no se ha documentado. Las aves, en especial las acuáticas, son reservorios de la infección. Cada serotipo se identifica mediante las proteínas de la superficie conocidas como "H" y "N". Las tres cepas comunes que afectan al cerdo son H1 N1, H1 N2 y H3 N2 . Estos serotipos tienen cepas con diferente patogenicidad (capacidad para producir enfermedad).
Signos clínicos
El período de incubación de la enfermedad es muy breve, de 12-48 horas. Cuando el virus ingresa por primera vez a la granja, se pueden observar dos o tres animales enfermos durante los primeros 2 días y luego un brote explosivo rápido de inapetencia y enfermedad clínica grave. Los efectos sobre el aparato reproductivo se observan después del inicio súbito de una enfermedad respiratoria de diseminación rápida con tbs, neumonía, fiebre e inapetencia. La dificultad respiratoria aguda persiste durante un período de 7-1 O días (de acuerdo con la magnitud del contacto entre grupos de cerdas). La infección causa infertilidad durante tres períodos importantes. En primer lugar, la enfermedad durante los primeros 21 días de la gestación puede impedir la implantación de los embriones en desarrollo, lo cual produce incremento de repeticiones de celo en el día 21. Si la gestación se ha establecido 14-16 días después de la cubrición y luego fracasa, se producen repeticiones de celo retrasadas. Segundo, si la infección se produce en las primeras 5 semanas de la gestación, podría haber mortalidad y reabsorción de todos los embriones y las cerdas sufrirán una pseudogestación con ausencia de embriones. La infección en este estadio también puede afectar el tamaño de la camada debido a la reabsorción de embriones. La enfermedad al final de la gestación también puede producir abortos o fetos con momificación tardía. El tercer efecto importante es sobre el verraco, ya que las temperaturas corporales elevadas afectan al semen y disminuyen la fertilidad durante un período de 4 a 5 semanas. La IP se puede volver endémica en granjas grandes, con brotes intermitentes de e nfermedad e infertilidad y diferentes cepas pueden causar infección secuencial. La inmunidad frente a los virus de la influenza suele ser breve (6 meses) y el perfil de inmunidad en la explotación puede tener una variación considerable con el tiempo. A nivel de la granja también se puede observar:
- Inicio repentino y rápido de enfermedad aguda en cerdas.
- Diseminación rápida de tos y neumonía.
- Normalización clínica en un período de 7-1 O días.
- Retraso en la salida en celo postdestete.
- Aumento de las repeticiones cíclicas.
- Aumento de las repeticiones acíclicas.
- Aumento de cerdas sin embriones.
- Incremento de los abortos, especialmente tardíos. Tasas más elevadas de nacidos muertos y partos lentos.
- En algunas ocasiones, incremento de fetos momificados.
Diagnóstico
Con frecuencia, el diagnóstico se establece por los signos clínicos porque ninguna otra enfermedad tiene un inicio y efectos clínicos tan evidentes. Las muestras de sangre obtenidas al comienzo de la enfermedad en cerdas afectadas y al cabo de 2-3 semanas muestran niveles crecientes de anticuerpos contra el virus específico. El virus de la IP (VIP) se replica con facilidad en los hisopos nasales y faríngeos y es posible identificarlo en el laboratorio. Este suele ser el mejor enfoque para confirmar el diagnóstico.
Enfermedades similares
La enfermedad aguda tiene una diseminación tan espectacular en cerdos de todas las edades que pocas afecciones se pueden confundir con ella. Sin embargo, en casos endémicos puede ser difícil diferenciarla de otras infecciones víricas, pero se deben considerar PRRS, CVRP, EA y mal rojo (figs. 6-2 y 6-3).
Tratamiento
- Las hembras o los verracos de cría con enfermedad aguda, temperatura elevada, asociada con aumento de la frecuencia respiratoria, deben recibir antibióticos de amplio espectro durante 3 días.
- Los fármacos adecuados comprenden penicilina/ estreptomicina, OTC de acción prolongada o penicilinas sintéticas como amoxicilina. Si la enfermedad es grave, se debe medicar el agua con CTC u OTC, 25 g (100% puro)/l 000 kg de peso vivo/día, durante 5 días.
Es importante prevenir las infecciones bacterianas secundarias.
- Mantener a las cerdas en una temperatura ambiente de 20-23ºC (70-75º F).
- Reducir todos los factores estresantes posibles, como las corrientes de aire.
- Mantener secos el lecho y las superficies del suelo .
- Supervisión estricta de los verracos para detectar signos de enfermedad .
- Identificar a los verracos que han estado enfermos y realizar las cubriciones con otro verraco durante las siguientes 4 semanas .
- Realizar las cubriciones mediante IA seguida por monta natural y considerar una segunda dosis de IA (am/pm/am) .
- Medicar el agua con vitaminas solubles durante 7 días.
- Medicar el pienso como se describió antes durante 2 semanas.
- Si los verracos tienen períodos de anorexia, realizar dos estudios de sangre con un intervalo de 2 semanas para establecer el diagnóstico.
- Debido a las vías posibles de introducción del virus en la granja, es muy difícil mantener a estas poblaciones libres de infección. Algunos países disponen de vacunas inactivadas que parecen conferir protección. En las granjas con circulación periódica del virus y enfermedad, se debe explorar esta forma de prevención.
- Si se considera que la granja está libre de infección (lo cual se puede confirmar mediante estudios serológicos), comprar la reposición en explotaciones con antecedentes similares y seronegativas. Sin embargo, este enfoque parece ser poco práctico.

 © 2000 - 2021. Global Ag MediaNinguna parte de este sitio puede ser reproducida sin previa autorización.
© 2000 - 2021. Global Ag MediaNinguna parte de este sitio puede ser reproducida sin previa autorización.