Artículos
El rendimiento reproductivo de cerdas – Parte 2 - efecto del estrés en la preñez temprana
26 February 2016No existe duda que el estrés es uno de los principales factores que reducen el rendimiento reproductivo en la cerda.

Artículo de Reinaldo Cubillos G., Veterinario. Máster en Sanidad y Producción Porcina. Coach profesional, Director Consultora SwineAdvisor, Chile.
La primera parte de esta serie trató con el rendimiento reproductivo de cerdas en relación al sistema de alojamiento: El rendimiento reproductivo de cerdas alojadas en corrales y jaulas de gestación – Parte 1
El efecto del estrés en la preñez temprana
No existe duda que el estrés es uno de los principales factores que reducen el rendimiento reproductivo en la cerda (Einarsson et al., 1996). El estrés es definido como el desequilibrio de la homeostasis y existe diversos factores que pueden afectar la condición reproductiva de la cerda, como la alta densidad, la alta temperatura, deficiencias nutricionales, reagrupamientos, interacción hombre-animal que generen un trauma físico-psicológico, etc (Varley y Stedman, 1994; Salak-Johnson et al., 2007).
Las manifestaciones de estrés están asociadas con la activación de los sistemas adreno-hipotalamico-hipófosis (AHH) y simpático adreno-medular (SAM) (Einarsson et al., 1996). La activación del AHH da lugar a la secreción de péptidos, principalmente de la hormona liberadora de corticotrofinas (CRH) y vasopresina (VP) a partir del hipotálamo (Einarsson et al., 1996).
La CRH estimula la liberación de propiomelanocortina (POMC), betaendorfinas y hormona adrenocorticotrofica (ACTH), la producción de esta última es regulada por la VP (Einarsson et al., 1996). La ACTH promueve la secreción de corticoesteroides a través de la corteza adrenal, entre ellos principalmente, el cortisol (Einarsson et al., 1996).
El cerdo en situaciones de estrés responde con elevadas concentraciones plasmáticas de cortisol, por ejemplo, se ha reportado en cerdas destetadas que no demuestran celo, que poseen elevadas concentraciones de cortisol y betaendorfinas.
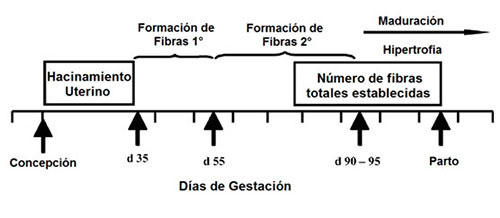
Los embriones porcinos ingresan en el útero 2 a 3 días posterior a la concepción en estado de mórula con 2 a 8 divisiones celulares, luego del día 6 los embriones se distribuyen dentro de los cuernos uterinos, este proceso termina alrededor del día 12, posteriormente, entre el día 13 y 14 ocurre la implantación (Dantzer, 1985).
El comienzo de la unión entre el trofoblato y las membranas uterinas dan paso al embrioblasto, que generalmente está desarrollado al día 18 de gestación. En este momento, la secreción de estrógenos es fundamental, la cual alcanza su pico el día 27, posteriormente decrece, para que la progesterona luteal se vuelva la hormona fundamental para el mantenimiento de la gestación (Einarsson et al., 1996).
Diversos estudios han demostrado que la mortalidad embrionaria ocurre antes del día 18 de gestación (Einarsson et al., 1996; Spoolder et al., 2009).
Efecto del tratamiento con ACTH o glucocorticoides
La respuesta frente a un factor estresor es reflejada por un aumento de las concentraciones de ACTH, quien estimula la producción de glucocorticoides en la glándula adrenal, a raíz de esto, investigadores han sometido a cerdas bajo tratamientos de ACTH y han observado que la cantidad de embriones se puede reducir hasta en un 40% (Arnold et al., 1982). Adicionalmente reportaron que una alta cantidad de cortisol sanguíneo, altera las dinámicas de secreción de las hormonas de la gestación (estradiol y progesterona) (Behrens et al., 1993).
Deficiencia nutricional
La deficiencia nutricional podría resultar de la subordinación de animales dentro de una colectividad, que se ven influenciado drásticamente en la tasa de ovulación, fecundación e implantación de los embriones (Einarsson et al., 1996; Razdan et al., 2004).
La privación de agua y pienso son factores estresantes e incrementar los niveles de cortisol en cerdos (Einarsson et al., 1996). Anderson (1975) examinó el efecto de la privación de pienso en nulíparas en el primer tercio de gestación, la nulíparas (36) fueron privadas 10 días antes de la monta natural hasta los 45 días posteriores, esto concluyó que a medida que el largo de la inanición aumenta, es menos probable mantener la gestación.
Fisiológicamente, en momentos de estrés nutricional las dinámicas de secreción hormonal se alteran, existiendo una alta concentración de progesterona durante los primeros 18 días de gestación y una menor concentración de estradiol (Tsuma et al., 1996; Razdan et al., 2004).
La secreción de estradiol al día 12 de gestación está altamente correlacionada con el tamaño del embrión y la elongación de la placenta, esta última característica es muy importante para la sobrevivencia del embrión dentro del útero (Razdan et al., 2004).
Efecto de la temperatura
Los cerdos son susceptibles a las temperaturas altas debido a su baja capacidad para eliminar calor (Einarsson et al., 1996). Diversos estudios han demostrado el efecto de las altas temperaturas en el rendimiento reproductivo, el año 1968, Edwards et al., a través de estufas, sometieron a temperaturas de 38,9º Celsius y 23,4º Celsius a dos grupos de nulíparas, al día 35 de gestación fueron llevadas a matadero para conteo de cuerpos lúteos y embriones.
Los resultados demostraron que las cerdas que estuvieron a altas temperaturas durante los primeros 15 días de gestación, tuvieron una tasa de concepción y de embriones viables mucho menor que el grupo a 23,41 grados Celsius.

Efecto del alojamiento en grupo
Conductas agresivas en cerdas alojadas en grupos poseen una activación del sistema adrenocortical (Pedersen et al., 1993). Una de las conductas que han aparecido con el alojamiento de cerdas en grupo, son las estereotipias, entre ellas principalmente, el rechinar de dientes, y mordeduras de hierros de jaulas (Chapinal et al., 2010).
Es inevitable que las cerdas que son reagrupadas no peleen, por lo menos se necesitan 48 horas para que el grupo de establezca jerárquicamente (Razdan et al., 2004). Muy pocos estudios han sido publicados para demostrar si existe un efecto importante cuando se alojan cerdas en grupos.
Bokma (1990), sometió cerdas para evaluar el rendimiento reproductivo de acuerdo a las condiciones de alojamiento, grupos de entre 25 a 50 cerdas fueron mantenidas en corrales colectivos hasta la primera semana posterior a la monta, mientras que otros grupos de la misma cantidad fueron alojados hasta la cuarta semana de gestación.
Las cerdas alojadas hasta la primera semana tuvieron un 20% de repeticiones y 10,5 lechones nacidos vivos, mientras que el otro grupo tuvo un 10% de repeticiones y 10,7 lechones nacidos vivos.
Este mismo autor, en otro experimento evaluó el rendimiento reproductivo en nulíparas alojadas en jaulas, en corral con otras nulíparas y en corral con cerdas mayores, a estas se les evaluó el tamaño de la camada, el cual fue 10,9 (75 camadas), 10,7 (84 camadas) y 10,1 (79 camadas), respectivamente. El peso promedio de las camadas decreció en el mismo orden que el tamaño de las camadas.
El alojamiento en corral a partir de los 4 días posteriores a la inseminación artificial (IA), fue obligatoria en Holanda a partir del 1 de enero del 2013, mientras que los demás países de la UE, en esta misma fecha, debieron alojar las cerdas en corral a partir de las 4 semanas post-IA (Spoolder et al., 2009). A raíz de esto, numerosos estudios se han publicado con el objeto de comparar el alojamiento en jaula y en corral y su efecto sobre el redimiendo reproductivo de las cerdas gestantes, sin embargo, existe poca literatura que compare diferentes sistemas en corral.
Algunas investigaciones mencionan que las cerdas alojadas en jaula sufren cojeras y lesiones en las articulaciones de una forma más significativa que las cerdas alojadas colectivamente (Spoolder et al., 2009).
Broom et al., (1995) sometieron a comparación diferentes sistemas de alojamiento en grupo. Este no encontró diferencias significativas en el rendimiento reproductivo, sin embargo, las cerdas alojadas en sistemas de alimentación electrónica (SAE) presentaron mayor conducta de peleas, especialmente luego del agrupamiento.
Backus et al., (1997) sostiene que las cerdas alojadas en sistemas de alimentación electrónica son alimentadas de una forma más eficiente que aquellas que son alojadas en corrales de libre acceso.
Investigadores australianos sometieron a nulíparas que fueron alojadas en corral a los 3-4 días post-IA y 8-9 dias post-IA, estos no encontraron diferencias significativas en las tasas de fertilidad.
Un estudio realizado por Geudeke et al., (2008), sometió una serie de granjas a un análisis epidemiológico con el fin de encontrar factores de riesgo en cerdas alojadas en grupo durante el primer mes de gestación. Este estudio comprendía un total de 96 granjas, 40 de ellas poseían graves problemas reproductivos y otras 56 granjas sin problemas de fertilidad. De las 96 granjas, 42 de ellas alojaban a sus cerdas en grupo el primer mes de gestación, de estas, 24 posean problemas reproductivos y 18 no poseían problema alguno.
A las granjas problema se les consideraba cuando tenían sobre un 10% de retornos de estros irregulares, que ocurren entre los 25 y 32 días post-IA (considerados por muerte embrionaria). Los resultaron mostraron que el odds ratio del riesgo por pérdida de muerte embrionaria en cerdas alojadas en grupo fue de 3.2 (p<0,01) en comparación a cerdas alojadas individualmente el primer mes de gestación.
Los peores resultados reproductivos se encontraron en las cerdas que fueron alojadas en grupo la primera y segunda semana post-IA. Un factor protector de mortalidad embrionaria encontrado en este estudio fue aquellas granjas que poseían cama de paja.
Van der Mheen et al., (2003) realizaron un estudio donde se comparó el rendimiento reproductivo de grupos grandes de cerdas (50) alojadas en corral con grupos pequeños (20), este mostró que existía una mayor cantidad de peleas y lesiones en piel en la cerdas alojadas en grupos grandes, sin embargo no se observaron diferencias en la tasa de fertilidad.
Chapinal et al., (2010) realizaron un estudio que tenía como objetivo comparar el bienestar y productividad de cerdas alojadas en jaulas y grupos con sistema de alimentación electrónica y alimentación trickle, se analizó el bienestar, niveles de proteína de fase aguda (APP), condición corporal y éxito reproductivo. Todas las cerdas del estudio estuvieron 29 días de gestación en jaula y posteriormente fueron trasladadas a los diferentes sistemas de estudio.
Los resultados mostraron que las cerdas alojadas en jaulas presentaron una mayor cantidad de estereotipias como masticación, además los sistemas de alimentación en grupo mostraron que el sistema de alimentación electrónica poseía mayores ventajas que el trickle, pues las cerdas pasaban mayor cantidad de tiempo echadas. En cuanto a los resultados reproductivos, no existieron diferencias significativas entre los 3 sistemas de alojamiento.
La industria porcina está evolucionando, muchas empresas de gran tamaño en el mundo están anunciando que van a sacar las jaulas de gestación en los próximos años y se van a buscar nuevas alternativas para el alojamiento en gestación de cedas, es por esto que para nosotros es fundamental estar enterado de las dinámicas que pueden afectar la gestación de la hembra porcina.
Referencias
1. Backus, G.B.C., Vermeer, H.M., Roelofs, P.F.M.M., Vesseur, P.C., Adams, J.H.A.N., Binnendijk, G.P., Smeets, J.J.J., Peet-Schwering, C.M.C., van der Wilt, F.J., 1997. Comparison of four housing systems for non-lactating sows. Research Institute for Pig Husbandry, Rosmalen. Report P1 171.
2. Barnett, J.L., Hemsworth, P.H., Cronin, G.M., Jongman, E.C., Hutson, G.D., 2001. A review of the welfare issues for sows and piglets in relation to housing. Australian Journal of Agricultural Research 52, 1–28.
3. Behrens, M.J., Kattesh, H.G. and Baumbach, G.A., 1993. Plasma and uterine cortisol, progesterone and protein changes in pseudopregnant gilts treated with hydrocortisone acetate. Theriogenology, 40: 1231- 1241.
4. Broom, D.M., Mendl, M.T., Zanella, A.J., 1995. A comparison of the welfare of sows in different housing conditions. Animal Science 61, 369–385.
5. Chapinal, N., Ruiz de la Torre., J.L., Cerisuelo, A., Gasa, J., Baucells, M., Coma, J., Vidal, A. and Mantenca, X. 2010. Evaluation of welfare and productivity in pregnant sows kept in stalls or in 2 different group housing systems. J Vet Beha. 5. pp. 82-93.
6. Coleman, G.J., Hemsworth, P.H., Hay, M., Cox, M., 2000. Modifying stockperson attitudes and behaviour towards pigs at a large commercial farm. Applied Animal Behaviour Science 66, 11–20.
7. Dantzer, V., 1985. Electron microscopy of the initial stages of placentation in the pig. Anat. Embryo]., 172: 281-293.
8. Edwards, R.L., Gmtvedt, LT.. Turman, E.J., Stephens, D.F. and Mahoney, G.W.A., 18. Reproductive performance of gilts following heat stress prior to breeding and in early gestation. J. Anim. Sci., 27: 1634- 1637.
9. Einarsson, S., Madej, A. and Tsuma, V. 1996. The influence of stress on early pregnancy in the pig. Anin. Reprod. Sci. 42. pp. 165-172.
10. Geudeke, M.J., 2008. Group housing of sows in early gestation: analysis of risk factors. Proceedings of the 20th IPVS Congress, Durban, South-Africa.
11. Hodgkiss, N.J., Eddison, J.C., Brooks, P.H., Bugg, P., 1998. Assessment of the injuries sustained by pregnant sows housed in groups using electronic feeders. Veterinary Record 143, 604–607.
12. Love, R.J., Evans, G., Klupiec, C., 1993. Seasonal effects on fertility in gilts and sows. Journal of Reproduction and Fertility Supplement 48, 191–206.
13. Mwanza, A.M., Englund, P., Knidahl, H., Lundeheim, N., Einarsson, S., 2000. Effects of post-ovulatory food deprivation on the hormonal profiles, activity of the oviduct and ova transport in sows. Animal Reproduction Science 59, 185–199.
14. Palomo A. 2008. Bienestar animal porcino: gestación en grupos. Tribuna de prensa.
15. Pedersen, L.J., Rojkittikhun, T., Einarsson, S. and Edqvist, L.-E., 1993. Postweaning grouped sows: effects of aggression on hormonal patterns and oestrous behaviour. Appl. Anim. Behav. Sci., 36: 25-39.
16. Peltoniemi, O.A.T., Virolainen, J.V., 2005. Seasonality of reproduction in female pigs. pp. 205-218. In: Ashworth, C.J., Kraeling, R.R. (Eds.), Control of Pig Reproduction VII. Nottingham University Press, England.
17. Razdan, P., Tummaruk, P., Kindahl, H., Rodriguez-Martinez, H., Hulte´n and F.,Einarsson, S.The impact of induced stress during Days 13 and 14 of pregnancy on the composition of allantoic fluid and conceptus development in sows. Theriogenology. 61. pp. 757-767.
18. Salak-Johnson, J.L., Niekamp, S.R., Rodriguez-Zas, S.L., Ellis, M., Curtis, S.E., 2007. Space allowance for dry, pregnant sows in pens: body condition, skin lesions and performance. Journal of Animal Science 85. pp. 1758–1769.
19. Spoolder, H., Geudeke, C., Van der Peet-Schwering, N., Soede, N. 2009. Group housing of sows in early pregnancy: A review of success and risk factors. Livestock science. 125. pp. 1-14.
20. Tsuma, V.T., Einarsson, S., Madej, A., Kiidahl, H. and Lundehehn, N., 1996. Effect of food deprivation during early pregnancy on endocrine changes in primiparous sows. Anim. Reprod. Sci., in press.
21. Turner, S.P., Horgan, G.W., Edwards, S.A., 2001. Effect of social group size on aggressive behaviour between unacquainted domestic pigs. Applied Animal Behaviour Science 74 (3), 203–215.
22. Varley, M. and Stedman, R., 1994. Stress and reproduction. In: D.J.A. Cole, J. Wiseman and M.A. Varley (Eds.), Principles of Pig Science. University Press, Nottingham, pp. 277-289.
23. Van der Mheen, H.W., Spoolder, H.A.M., Kiezebrink, M.C., 2003. Stabiele of wisselgroepen voor drachtige zeugen [Stable or dynamic groups for pregnant sows]. Praktijkrapport Varkens, vol. 23. Animal Sciences Group, Wageningen UR.
También le interesaría
El rendimiento reproductivo de cerdas alojadas en corrales y jaulas de gestación – Parte 1
Febrero 2016

 © 2000 - 2021. Global Ag MediaNinguna parte de este sitio puede ser reproducida sin previa autorización.
© 2000 - 2021. Global Ag MediaNinguna parte de este sitio puede ser reproducida sin previa autorización.